|
Відділ
хімії комплексних сполук
Нові координаційні сполуки платинових металів з O-, N-, S-вмісними
фізіологічно активними молекулами, похідними гідразонів, амінів, саліцилальдімінів,
тіосечовини та імінотіазолів.

В даному циклі досліджень ми направили зусилля на синтез, дослідження
фізико-хімічних властивостей та будови нових координаційних сполук благородних
металів з рядом фізіологічно активних молекул – лігандів для встановлення
можливості їх використання в медицині. В якості фізіологічно активних лігандів
нами обрані функціонально заміщені похідні гідразонів 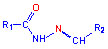 ,
амінів ,
амінів 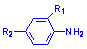 ,
азометинів (саліцилальдімінів) ,
азометинів (саліцилальдімінів) 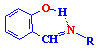 ,
тіосечовини (наприклад, тіосемикарбазонів) ,
тіосечовини (наприклад, тіосемикарбазонів) 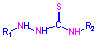 ,
імінотіазолів. ,
імінотіазолів.
Чому саме ці об’єкти?
Платинові метали.
Хімія платинових металів завжди привертала увагу дослідників, що обумовлено,
не в останню чергу, широкою гамою ступенів їх окиснення, реалізація яких можлива
для цих елементів в сполуках.
Відомо, що сполуки і матеріали на основі платинових металів, зокрема
рутенію, родію та паладію, володіють комплексом цінних фізико-хімічних
властивостей, які дозволяють використовувати їх в якості каталізаторів в
процесах гомогенного та гетерогенного каталізу, для використання плівок і
різного роду покриттів, для синтезу біологічно активних сполук та аналітичних
реагентів.
В нашому Інституті проводиться цілеспрямований синтез комплексів Ru, Rh и Pd з
наступним дослідженням їх за логічним ланцюгом СКЛАД→БУДОВА→ВЛАСТИВОСТІ→ФУНКЦІЯ
як показано на рис. 1. При цьому склад та будова визначаються набором сучасних
фізико-хімічних методів дослідження: елементний хімічний аналіз, ІЧ, ЕСП, РФС,
спектроскопія дифузійного відбиття, ЯМР ЯМР Н1, Н1-Н1,
С13, термогравіметрія, РСА. Функціонування комплексів вивчається в двох
напрямках:
- в якості аналітичних форм для розділення та виділення Ru, Rh и Pd з природної та промислової сировини.
- в якості прекурсорів нових медпрепаратів для терапії серцево-судинних чи онко-захворювань.
Останні десятиліття в хімії платинових металів сформувалось новий науковий напрям –
біокоординаційна хімія, що знаходиться на перетині таких областей науки, як
координаційна хімія, біохімія, біофізика, медицина. Добре відома протипухлинна
активність сполук платини, однак в наш час інтенсивно ведеться пошук більш активних
та менш токсичних препаратів і на основі інших платинових металів, зокрема рутенію,
родію та паладію.
Виявлена висока ефективність фталоціанінових комплексів рутенію в фото
динамічній терапії опухолей, протипухлинна та антиметастатична активність
комплексів Ru з імідазолом. Припускається, що комплекси Ru(III) діють в якості
проліків, перетворюючись в результаті відновлення in vivo в відповідну активну
форму. На основі паладієвих сполук розроблено лікарський препарат етазол, що володіє
імуномоделюючою дією, який полегшує імунну відповідь при імунодефіцитному стані
організму, наприклад, після опромінення. Деякі сполуки паладію володіють антифаговою
активністю, інгібують мембранозв’язані ферменти, проявляють гістамініліберуючі та
гістамінзв’язуючі властивості.
Лігандні системи.
Похідні гідразонів, амінів, азометанів (саліцилальдімінів та основ Шифа), тіосечовини
(тіосемикарбазони) та імінотіазолів відносяться до багатодентатних лігандів, оскільки
містять в своєму складі цілий ряд електронодорних атомів функціональних груп (ОН),
(С=О), (C=N), (C=S), (NH), здатність до донорно-акцепторної взаємодії яких змінюється
в залежності від умов синтезу та властивостей центрального атому – комплексоутворювачу.
Немаловажливий і факт існування цих молекул в формі різних таутомерів. В теоретичному
плані представляє інтерес можливість фіксації при комплексоутворенні різних таутомерних
форм лігандів, причому кількість можливих конформаційних та конфігураційних таутомерів
та ізомерів зростає при модифікації донорних атомів та ускладненні карбонільного або
азінного фрагментів в їх молекулах. Разом з тим, вони є багатоосновними кислотами. Така
гама хімічних особливостей дає можливість синтезу за їх участю різноманітних
координаційних сполук різного складу та будови. Безумовно, ці сполуки представляють
інтерес і для практичних цілей.
Згадується їх використання в сільському господарстві і медицині, де вони перспективні
при лікуванні цілого ряду захворювань: нелегеневої форми туберкульозу, тонзиліту, грипу,
віспи, поліомієліту. Встановлена анти грибкова та фунгіцидна активність азометанів та їх
металокомплексів, що зростає при наявності в молекулі ліганду гідроксильної групи.
Комплекси з тетра- та тридентатними основами Шифа, наряду з протизапальними та
бактерицидними властивостями, проявляють протипухлинну дію по відношенню до асцитної
форми раку Еріха, карноми Уокер-256, саркоми 180.
Тіосемикарбазони та імінотіазоли є багатообіцяючими органічними молекулами в
біокоординаційній хімії, тому що в них містяться фрагменти, які відповідають виключно
за протипаразитну, антибактеріальну та протипухлинну активність. В деяких
тіосемикарбазонах спостерігається підвищення протипухлинної активності за рахунок
специфічної можливості їх хелатувати з іонами металів. Ці ліганди утворюються за
рахунок конденсації тіосемикарбазиду та альдегіду, які також можуть формувати ще
додаткові координаційні місця. Зазвичай тіосемикарбазони координуються до металу
через імінний азот та атом сірки. Однак за рахунок можливості протікання різних
таутомерних переходів та модифікації їх складових, вони можуть мати більш ніж два
координаційних донорних атоми, і таким чином утворювати більшу кількість координаційних
сполук.
Похідні імінотіазолів є інгібіторами фактору, визваного гіпоксією. В додаток до цього
вони володіють протипухлинною дією за рахунок здатності уповільнювати ріст ракових клітин.
Для розуміння механізму дії і транспорту в організмі біоактивних координаційних сполук
перш за все необхідно знання процесів комплексоутворення платинових металів з лігандами,
що містять фармакоформні групи атомів. До таких лігандів і відносяться вищезгадані
азометани, гідра зони, аміни та карботіаміди.
Вище перераховані властивості деяких комплексів визвали наш інтерес до розробки методів
синтезу, а також до дослідження фізико-хімічних і біохімічних властивостей нових
координаційних сполук благородних металів, що, частково, може внести деякий внесок в
розвиток розуміння взаємозв’язку будови та біоактивності сполук для можливого в
перспективі целенаправленого синтезу нових сполук з прогнозованими властивостями.
Що нами зроблено в цьому напрямку?
1. Розроблені методи синтезу, синтезовані, виділені в індивідуальному стані
десятки нових координаційних сполук рутенію, родію, паладію та платини з похідними
гідразонів, амінів, азометанів, тіосемикарбазонів. Визначені їх склад, структура та
фізико-хімічні властивості. Встановлені загальні закономірності, що мають місце в
процесі комплексоутворення металів з лігандами, а також фактори, що впливають на
склад, будову та фізико-хімічні властивості отриманих координаційних сполук.
Встановлено:
-
наприклад, для Ru(III), Rh(III) Pd(II) з похідними гідразону, що в залежності
від умов синтезу (рН середовища, концентрації та стехіометрії вихідних компонентів,
тривалості та температури синтезу) та природи замісників в лігандах утворюються тетра-,
пента- чи гексакоординаційні сполуки рутенію, родію та паладію молекулярного чи іонного
(аніонного чи катіонного) типу з координацією ліганду як в амідній монодепротонованій
цис- чи транс-формі, так і в імідольній бідепротонованій формі. Реалізація в комплексі
амідної або імідольної форми гідра зону залежить від рН середовища синтезу. Від інших
умов синтезу залежить утворення моно- та біядерних комплексних сполук. Комплекси Ru(III)
та Rh(III) мають псевдооктаедричну будову з координацією ліганду бі- чи
тридентатноциклічно через атоми кисню/сірки гідроксильної (ОН) і карбонильної/тіо-
(С=О)/(C=S) чи імідольної/тіольної (С-О)/(C-S)-груп, а також через азометиновий атом
азоту. Вивчено вплив донорних і акцепторних замісників в молекулах гідразонів на
комплексоутворення рутенію і родію. Встановлено, що комплекси іонного типу частково чи
повністю розчинні у воді, в той час, як самі гідра зони нерозчинні.
Від інших умов синтезу залежить утворення моно- та біядерних комплексних сполук.
Комплекси Ru(III) і Rh(III) мають псевдооктаедричну будову з координацією ліганду
бі- чи тридентатноциклічно через атоми кисню/сірки гідроксильної (ОН) і
карбонільної/тіо- (С=О)/(C=S) чи імідольної/тіольної (С-О)/(C-S)-груп, а також через
азометиновий атом азоту. Вивчено вплив донорних і акцепторних замісників в молекулах
гідразонів на комплексоутворення рутенію та родію. Встановлено, що комплекси іонного
типу частково чи повністю розчинні у воді, в той час, як самі гідразони нерозчинні.
-
У випадку отримання сполук з похідними саліцилальдімінів і карботіоамідів вирішальну
роль також відіграють умови синтезу, що впливають значною мірою на формування
комплексів різного складу, будови і форму координованого ліганду. Варіацією умов
синтезу можна отримати комплекси як в формі халатів, так і в формі адуктів. При цьому
у воді розчиняються або адукти, або хелати іонного типу.
-
В комплексах родію і паладію з похідними саліцилальдіміну ліганд координується до
металу у вигляді аніону бідентатноциклічно через азометиновий азот і кисень
депротонованої ОН групи. Наявність внутрішньомолекулярних водневих зв’язків в
молекулі ліганду призводить до утворення комплексу паладію(ІІ), в якому нейтральна
молекула ліганду координується монодентатно через пірідіновий атом азоту. Однак,
в більшості випадків в залежності від умов синтезу утворюються комплекси паладію з
бідентатною координацією ліганду, подібно родієвим і рутенієвим комплексам.
Локалізація карботіоамідної групи в α-положенні відносно піридинового ядра призводить
до координації карботіоаміду через піридиновий атом азоту і сірку карботіоаміду
з реалізацією 6-членного халатного метало циклу. Варіація умов синтезу (рН,
температура, час нагрівання) призводить до утворення комплексів з різними формами
координованих лігандів. В комплексах, отриманих в кислому середовищі, карботіоаміди
координуються в тіонній формі. Тому в основному утворюються комплекси катіонного
характеру, розчинні у воді, що дозволяє досліджувати їх на біологічну активність.
-
Доведено, що вплив природи ліганду на формування координаційної сполуки обумовлено
різним стеричним розміщенням нуклеофіольних донорних центрів функціональних груп
ліганду, а також наявністю в ньому внутрішньомолекулярного водневого зв’язку.
Ріст кількості донорних центрів в молекулі ліганду не тільки впливає на його
дентатність, але і сприяє можливості його переходу в іншу форму, що показано на
прикладі взаємодії Pd(II) з похідними карботіоаміду, який в умовах синтезу
піддається циклізації з утворенням триазольного кільця.
2. Проведено дослідження термогравиметричної стійкості комплексів родію і
рутенію з похідними гідразонів.
Аналіз дериваторами досліджених координаційних сполук показав, що процес термічного
розкладання комплексів достатньо складний, і супроводжується появою на кривих ДТА
ряду ендо- та екзоефектів. Аналіз даних ІЧ та ЯМР Н1 спектрів продуктів термічного
розкладення комплексів дозволив зробити наступні висновки: деструкція комплексів
проходить поступово через поетапне відщеплення спочатку кристалізаційної води,
радикальних фрагментів органічних лігандів, іонів CI- у вигляді молекули НCI,
координаційної води з наступним окисненням залишку комплексу киснем повітря і
утворенням кінцевих продуктів термолізу М2O3 чи суміші М2O3 і Na2CO3.
Показана можливість ефективного застосування аніонних комплексів рутенію, родію та
паладію для екстракційно-фотометричного розділення та виділення їх з вторинної сировини.
Нами визначено, що для рутенію, родію та паладію характерни різна швидкість та оптимальні
інтервали рН утворення комплексів, що було використано нами для розробки високочутливої
і селективної методики екстракційно-фотометричного визначення, розділення та виділення
рутенію, родію та паладію при сумісній їх присутності в сумішах розчинів їх солей та
електролітах.
Крім цього, проведено певний цикл біохімічних досліджень.
З якою метою?
Як було відмічено нами вище, дослідження реакцій утворення комплексів платинових
металів з органічними молекулами дає ключ для розуміння механізмів протікання
багатьох біологічно важливих процесів. Наявність в металоорганічних сполуках
різного роду функціональних груп, піримидинових гетеро циклів, що грають ключову
роль в метаболітичних процесах живих організмів, обумовлює високу біологічну
активність як самих лігандів, так і комплексів. Вміст в таких сполуках спряжених
кратних зв’язків сприяє де локалізації неспареного електрону, внаслідок чого вони
є ефективними пастками високо реакційних радикалів, які утворюються в організмі
в умовах стресу.
Значення вільно радикального пошкодження підкреслював американський дослідник
Д. Харман, котрий відніс до вільнорадикальної патології променеву хворобу, рак,
атеросклероз, деякі захворювання печінки. Ф.З. Меерсон виявив, що в розвитку
стресових пошкоджень важливу роль відіграє перекисне окиснення ліпідів мембран.
Введення антиоксидантів попереджує ці процеси. Накопичення стресових факторів
впливає на функцію серцево-судинної системи. Це і знижує скорочувальну здатність
міокарду, порушення збудження, розвиток аритмій. При старінні зменшується надійність
антиоксидантного захисту організму і зростає роль вільно радикального пошкодження
клітин. Це обумовлює необхідність пошуку нових речовин з мембраностабілізуючею,
кальціймобілізуючею дією і здатністю забезпечити захист клітинних структур від
пошкоджуючи факторів.
Тому метою нашої роботи було: на основі фундаментальних наукових досліджень розробити
методи синтезу нових координаційних сполук металів платинової групи з кисень-, азот-,
халькогенвмісними, ароматичними, піридин-, піримідин-, тіазоло- і гетероциклічними
органічними лігандами, які б володіли антиоксидантною, ангіопротекторною,
кардіотонічною, кальцій обмінною активністю для корекції порушення діяльності
серцево-судинної системи в екстремальних кмовах, а також для регуляції Na, K, Ca
балансу та вивчення їх на реологічні властивості крові.
За попередніми дослідженнями було показано:
Що деякі комплекси рутенія і родія з саліцилальдімінами і гідра зонами з визначеним
способом координації до металу, володіють антиоксидантними властивостями подібно
вітаміну Е чи тролоксу.
На вивчення функціонування ізольованого серця дослідних тварин після обробки його
перфузованим розчином комплексів рутенію і родію встановлені кардіотонічні
властивості ряду синтезованих сполук. Показано, що використання їх "in situ"
попереджує розвиток репер фузійних пошкоджень серця. Встановлено, що за рахунок
активації мітохондріальних транзисторних пор клітин фениларсеноксидом відбувається
погіршення функціонального стану серця. Введення в систему отриманого нами
водорозчинного комплексу попереджує відкриття мітохондріальних пор, скоріш за все,
частково блокує їх відкриття, і, таким чином, знижує вплив на них активатору,
забезпечуючи вихід роботи серця в нормальний режим.
Таким чином, досліджені нами сполуки потенційно можуть бути ефективними компонентами
при створенні нових кардіотонічних препаратів. Але отримані нами дані свідчать про
необхідність подальшого ґрунтовного вивчення синтезованих комплексів
спеціалістами світового рівня.
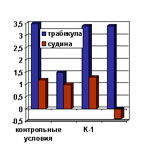
Зміни показників кардіодинаміки при ішемії – реперфузії
ізольованого серця лабораторних щурів лінії Вістар (n = 10)
в контрольних умовах.
(Таблиця відкривається в новому вікні.)
 |
 |
| Рис.1. Скорочувальні реакції ізольованих препаратів у відповідь на послідовну електричну стимуляцію: в контрольних умовах, після префузії ФАО, після перфузії комплексами родію. (5 мкмоль/л). |
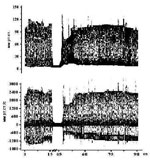
Рис.2. Зміна швидкості росту і падіння тиску в лівому шлуночку морскої свинки при ішемії – реперфузії в умовах попередньої реперфузії комплексною сполукою рутенію (10 мкмоль/л, n = 10). |
Основні виконавці:
кандидати хімічних наук – старший науковий співробітник Орисик Світлана Іванівна,
наукові співробітники Бонь Володимир Васильович и Рибачук Лариса Миколаївна.
|
|





 ,
тіосечовини (наприклад, тіосемикарбазонів)
,
тіосечовини (наприклад, тіосемикарбазонів)